Este apa esenţială pentru orice formă de viaţă?
alte articole
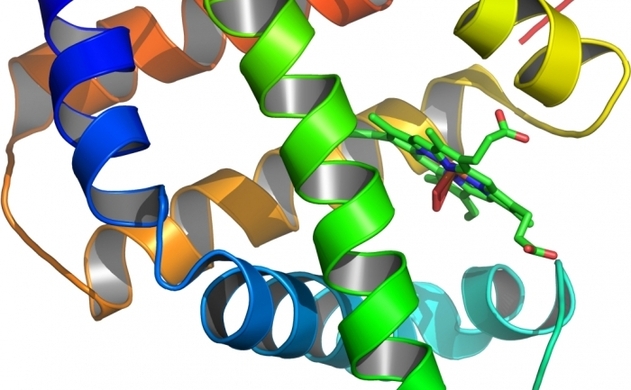
Când proteinele sunt încălzite, lanţurile lor lungi de molecule se desfac, făcându-le incapabile să-şi îndeplinească funcţiile vitale, cum ar fi conversia produselor alimentare în energie sau transmiterea de oxigen în sânge. S-a considerat anterior că apa ar fi esenţială in procesul de funcţionare şi de refacere a moleculelor de proteine, după ce s-au răcit din nou.
Un nou studiu de la Universitatea Bristol din Marea Britanie a demonstrat că o anumită proteină – mioglobina, găsită în celulele roşii din sânge – poate să se refacă în lipsa apei.
"Rezultatele noastre contestă paradigma existentă privind rolul moleculelor de apă în funcţionarea şi refacerea proteinelor", a declarat Dr. Adam Perriman de la Şcoală de Chimie din Bristol pentru The Epoch Times, într-un e-mail. "Este o problemă extrem de complexă şi implică aproape toate tipurile de legături chimice, care, la rândul lor, sunt afectate de apă."
Desfacerea proteinelor este numită denaturare, şi apare atunci când sunt încălzite. Un exemplu clasic este fierberea unui ou, când proteinele din ou se desfac şi se lipesc între ele, formând oul solid. Procesul nu poate fi inversat în cazul ouălor, dar unele proteine pot reveni la structura lor originală, când se răcesc.
În 1990, cercetătorii au arătat că moleculele de carbon - carbonul dintr-o structură chimică ce se aseamănă cu o minge de fotbal - nu au o fază lichidă. Asta înseamnă că "dacă se încălzeşte un eşantion uscat al acestui material, acesta se va sublima şi va forma un gaz. Alternativ, dacă s-ar răci gazul, el va forma o formă solidă", a explicat Perriman. "Acest fenomen fără precedent a apărut din cauza dimensiunilor moleculelor de carbon la scara nanometrică. Proteinele sunt şi ele elemente la scara nanometrica şi, în consecinţă, nu au o fază lichidă."
Perriman şi colegii săi au reproiectat suprafaţa moleculei de mioglobină purtătoare de oxigen, folosind tensioactivi polimerici, astfel că proteina se putea "ţopi" şi a îndepărtat toate urmele de moleculele de apă din jurul ei.
"Când am realizat că structura proteinei era intactă şi în lipsa apei (sau a oricărui alt solvent), am decis să analizăm dacă proteina ar putea fi desfăcută termic şi refăcută după răcire", a susţinut Perriman. "Aşa s-a întâmplat."
În laboratorul sincrotron din Oxfordshire, Diamond Light Source, cercetătorii au folosit o tehnică numită dicroism circular pentru a observa modul în care structura mioglobinei modificate s-a schimbat după încălzire. Ei au descoperit că proteina a rămas stabilă până la o temperatură mult mai mare decât ce se găseşte în natură.
"În apă, cele mai multe proteine se desfac (se denaturează) la 70 - 80 de grade Celsius [158 - 176 de grade Fahrenheit]; cu toate acestea, am observat că desfacerea într-un sistem fără solvenţi se realizează la 155 de grade Celsius [311 de grade Fahrenheit]", a spus Perriman.
Aceste descoperiri ar putea fi utile în dezvoltarea enzimelor industriale cu o rezistenţă termică ridicată, în zonele în care condiţiile de mediu pot fi dure, a afirmat Perriman. "Unul din rezultatele noastre cheie a fost creşterea foarte mare a stabilităţii proteinelor. Mai mult decât atât, proteinele noastre lichide au concentraţii extrem de ridicate de proteine, aspect ce poate fi avantajos."
Alte aplicaţii ar putea include un pansament inteligent care ar putea fi "aplicat dintr-o cutie, cum sunt aerosolii", a relatat Perriman. "În acest moment, domeniul este nou, dar avem în vedere câteva sisteme noi, care implică mai multe enzime industriale relevante."
Rezultatele au fost publicate online în revista Chemical Science.